por Tung Thanh Le, Zacharias Andreadakis, Arun Kumar, Raúl Gómez Román, Stig Tollefsen, Melanie Saville y Stephen Mayhew.
La secuencia genética del SARS-CoV-2, el coronavirus que causa COVID-19, se publicó el 11 de enero de 2020, lo que desencadenó una intensa actividad global de I + D para desarrollar una vacuna contra la enfermedad.
La escala del impacto humanitario y económico de la pandemia de COVID-19 está impulsando la evaluación de las plataformas de tecnología de vacunas de próxima generación a través de nuevos paradigmas para acelerar el desarrollo, y el primer candidato a la vacuna de COVID-19 ingresó a pruebas clínicas en humanos con una rapidez sin precedentes el 16 de marzo de 2020.
La Coalition for Epidemic Preparedness Innovations (CEPI) está trabajando con las autoridades sanitarias mundiales y los desarrolladores de vacunas para apoyar el desarrollo de vacunas contra COVID-19.
Para facilitar este esfuerzo, hemos desarrollado y mantenemos continuamente una visión general del panorama global de la actividad de desarrollo de la vacuna COVID-19.
Nuestra base de datos incluye programas de desarrollo de vacunas informados a través de la lista autorizada y continuamente actualizada de la OMS, junto con otros proyectos identificados a partir de fuentes públicas disponibles y propietarias.
El panorama proporciona información sobre las características clave de la I + D de la vacuna COVID-19 y sirve como un recurso para la gestión continua de la cartera en CEPI.
También hemos compartido nuestra información del paisaje con otros en el ecosistema de salud global para ayudar a mejorar la coordinación en la respuesta al brote de COVID-19 y permitir que los recursos y capacidades globales se dirijan hacia los candidatos a vacunas más prometedores.
Panorama de la I + D en la vacuna COVID-19
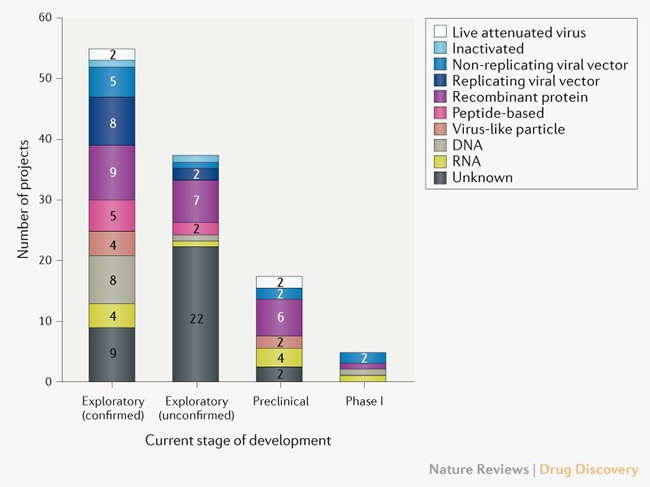
A partir del 8 de abril de 2020, el panorama global de I + D de la vacuna COVID-19 incluye 115 vacunas candidatas (Fig.1), de las cuales 78 están confirmadas como activas y 37 no están confirmadas (el estado de desarrollo no puede determinarse a partir de fuentes de información privadas o de propiedad pública).
De los 78 proyectos activos confirmados, 73 se encuentran actualmente en etapas exploratorias o preclínicas.
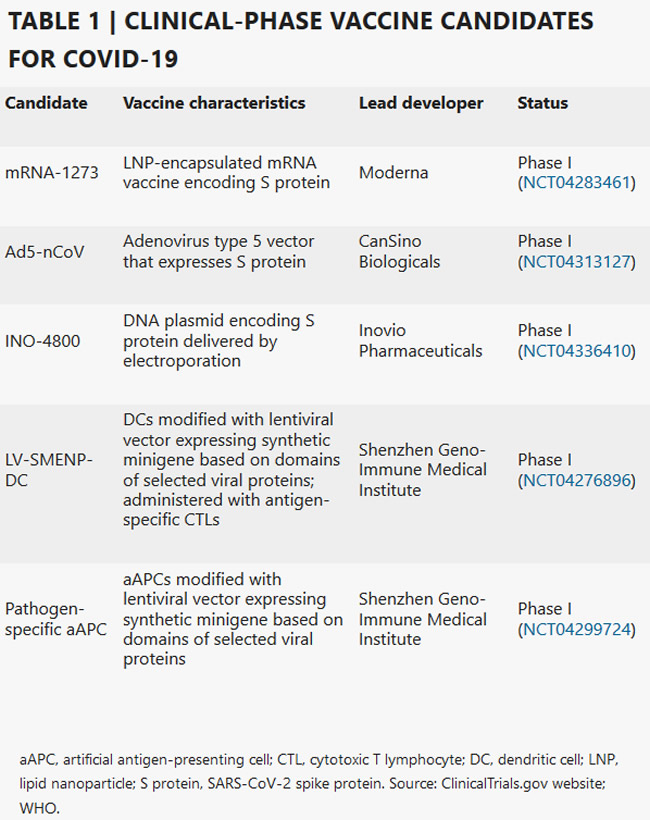
Los candidatos más avanzados se han movido recientemente al desarrollo clínico, incluyendo mRNA-1273 de Moderna, Ad5-nCoV de CanSino Biologicals, INO-4800 de Inovio, LV-SMENP-DC y aAPC específico de patógeno del Instituto Médico Geno-Inmune de Shenzhen (Tabla 1)
Muchos otros desarrolladores de vacunas tienen Planes indicados para iniciar pruebas en humanos en 2020 .
Diversidad de plataformas tecnológicas
Una característica sorprendente del panorama de desarrollo de vacunas para COVID-19 es la gama de plataformas tecnológicas que se evalúan, que incluyen ácido nucleico (ADN y ARN), partículas similares a virus, péptidos, vectores virales (replicantes y no replicantes), proteínas recombinantes, virus vivos atenuados y virus inactivados (Fig. 1).
Muchas de estas plataformas no son actualmente la base para las vacunas autorizadas, pero la experiencia en campos como la oncología está alentando a los desarrolladores a aprovechar las oportunidades que ofrecen los enfoques de próxima generación para una mayor velocidad de desarrollo y fabricación.
Es concebible que algunas plataformas de vacunas se adapten mejor a subtipos de población específicos (como ancianos, niños, mujeres embarazadas o pacientes inmunocomprometidos).
Teniendo en cuenta los candidatos en la Tabla 1, las nuevas plataformas basadas en ADN o ARNm ofrecen una gran flexibilidad en términos de manipulación de antígenos y potencial de velocidad.
De hecho, Moderna comenzó las pruebas clínicas de su vacuna basada en ARNm mRNA-1273 solo 2 meses después de la identificación de la secuencia.
Las vacunas basadas en vectores virales ofrecen un alto nivel de expresión de proteínas y estabilidad a largo plazo, e inducen fuertes respuestas inmunes.
Finalmente, ya existen vacunas autorizadas basadas en proteínas recombinantes para otras enfermedades, por lo que dichos candidatos podrían aprovechar la capacidad de producción a gran escala existente.
Para algunas plataformas, los adyuvantes podrían mejorar la inmunogenicidad y hacer que las dosis más bajas sean viables, permitiendo así la vacunación de más personas sin comprometer la protección.
Hasta ahora, al menos 10 desarrolladores han indicado planes para desarrollar vacunas adyuvantes contra COVID-19, y los desarrolladores de vacunas, incluidos GlaxoSmithKine , Seqirus y Dynavax, se han comprometido a poner a disposición adyuvantes con licencia (AS03, MF59 y CpG 1018, respectivamente) para usar en vacunas desarrolladas por otros.
La información pública sobre los antígenos específicos de SARS-CoV-2 utilizados en el desarrollo de vacunas es limitada.
La mayoría de los candidatos para los que hay información disponible apuntan a inducir anticuerpos neutralizantes contra la proteína del pico viral (S), evitando la absorción a través del receptor ACE2 humano.
Sin embargo, no está claro cómo las diferentes formas y / o variantes de la proteína S utilizada en diferentes candidatos se relacionan entre sí o con la epidemiología genómica de la enfermedad.
La experiencia con el desarrollo de la vacuna contra el SARS indica el potencial de efectos de mejora inmunológica de diferentes antígenos, lo cual es un tema de debate y podría ser relevante para el avance de la vacuna.
Perfil de los desarrolladores de vacunas
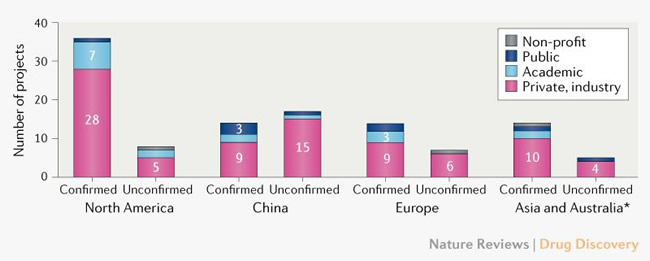
De los candidatos a vacunas activas confirmadas, 56 (72%) están siendo desarrollados por desarrolladores privados / industriales, y los 22 (28%) proyectos restantes están dirigidos por organizaciones académicas, del sector público y otras organizaciones sin fines de lucro.
Aunque varios grandes desarrolladores de vacunas multinacionales (como Janssen , Sanofi , Pfizer y GlaxoSmithKine ) se han involucrado en el desarrollo de la vacuna COVID-19, muchos de los principales desarrolladores son pequeños y / o no tienen experiencia en la fabricación de vacunas a gran escala.
Por lo tanto, será importante garantizar la coordinación de la fabricación de vacunas y la capacidad de suministro y la capacidad para satisfacer la demanda.
La mayor parte de la actividad de desarrollo de la vacuna COVID-19 se encuentra en América del Norte, con 36 (46%) desarrolladores de los candidatos de vacuna activa confirmada en comparación con 14 (18%) en China, 14 (18%) en Asia (excluyendo China) y Australia, y 14 (18%) en Europa.
Se han informado esfuerzos adicionales de desarrollo de vacunas para China, y CEPI está en diálogo con el Ministerio de Ciencia y Tecnología de China para confirmar su estado.
Los desarrolladores principales de candidatos activos a la vacuna COVID-19 se distribuyen en 19 países, que en conjunto representan más de las tres cuartas partes de la población mundial.
Sin embargo, actualmente no hay información pública sobre la actividad de desarrollo de vacunas en África o América Latina, aunque en estas regiones existen marcos regulatorios y de capacidad de fabricación de vacunas. La epidemiología de COVID-19 puede diferir según la geografía, y es probable que el control efectivo de la pandemia requiera una mayor coordinación y participación del hemisferio sur en los esfuerzos de investigación y desarrollo de vacunas.
Panorama actual
El esfuerzo global de I + D de vacunas en respuesta a la pandemia de COVID-19 no tiene precedentes en términos de escala y velocidad.
Dado el imperativo de la velocidad, hay una indicación de que la vacuna podría estar disponible bajo uso de emergencia o protocolos similares a principios de 2021 .
Esto representaría un cambio fundamental de la vía tradicional de desarrollo de vacunas, que toma un promedio de más de 10 años , incluso en comparación con el plazo acelerado de 5 años para el desarrollo de la primera vacuna contra el Ébola , y necesitará nuevos paradigmas de desarrollo de vacunas que involucren paralelos y adaptativos. fases de desarrollo, procesos regulatorios innovadores y escalado de capacidad de fabricación.
Los puntos de referencia de la industria para los paradigmas tradicionales de desarrollo de vacunas citan tasas de deserción para vacunas autorizadas de más del 90% .
Es probable que los enfoques que se aplican para el desarrollo de COVID-19, que involucran un nuevo objetivo de virus y, a menudo, nuevas plataformas tecnológicas de vacunas y nuevos paradigmas de desarrollo, probablemente aumenten los riesgos asociados con la administración de una vacuna autorizada, y requerirán una evaluación cuidadosa de la efectividad y seguridad en cada paso.
Para evaluar la eficacia de la vacuna, se están desarrollando modelos animales específicos de COVID-19, incluidos ratones transgénicos ACE2, hámsters, hurones y primates no humanos. Se necesitan medidas de contención de nivel de bioseguridad 3 para estudios en animales que involucren desafíos de virus vivos, y es probable que la demanda de estas capacidades requiera coordinación internacional para asegurar que haya suficiente capacidad de laboratorio disponible.
Finalmente, se necesitará una fuerte coordinación y cooperación internacional entre los desarrolladores de vacunas, los reguladores, los encargados de la formulación de políticas, los financiadores, los organismos de salud pública y los gobiernos para garantizar que los candidatos prometedores de vacunas en etapa tardía puedan fabricarse en cantidades suficientes y suministrarse de manera equitativa a todas las áreas afectadas, especialmente a niveles bajos. -recursos de regiones. CEPI ha emitido recientemente una convocatoria de financiaciónpara apoyar los esfuerzos mundiales de desarrollo de vacunas COVID-19 guiados por tres imperativos: velocidad, fabricación y despliegue a escala, y acceso global.
Mantenemos un enfoque dinámico de gestión de cartera y haremos que nuestros recursos científicos habilitantes estén disponibles a nivel mundial.
Instamos a la comunidad mundial de vacunas a movilizar colectivamente el apoyo técnico y financiero necesario para abordar con éxito la pandemia de COVID-19 a través de un programa de vacunación global, y proporcionar una base sólida para enfrentar futuras pandemias.
Fuente: Nature
Traducción: Jorge Gómez Aracena


Hi there.
reddigital.cl, Thanks for keeping a thoughtful corner of the internet alive.
I recently published my ebooks and training videos on
https://www.hotelreceptionisttraining.com/
They feel like a hidden gem for anyone interested in hotel and management. These ebooks and videos have already been welcomed and found very useful by students in Russia, the USA, France, the UK, Australia, Spain, and Vietnam—helping learners and professionals strengthen their real hotel reception skills. I believe visitors and readers here might also find them practical and inspiring.
Unlike many resources that stay only on theory, this ebook and training video set is closely connected to today’s hotel business. It comes with full step-by-step training videos that guide learners through real front desk guest service situations—showing exactly how to welcome, assist, and serve hotel guests in a professional way. That’s what makes these materials special: they combine academic knowledge with real practice.
With respect to the owners of reddigital.cl who keep this platform alive, I kindly ask to share this small contribution. For readers and visitors, these skills and interview tips can truly help anyone interested in becoming a hotel receptionist prepare with confidence and secure a good job at hotels and resorts worldwide. If found suitable, I’d be grateful for it to remain here so it can reach those who need it.
Why These Ebooks and Training Videos Are Special
They uniquely combine academic pathways such as a bachelor’s degree in hospitality management or a master’s degree in hospitality management with very practical guidance on the hotel front desk job duties. They also cover the hotel front desk receptionist job description, and detailed hotel front desk tasks.
The materials go further by explaining the reservation systems in hotels, hotel check-in, check-out flow, guest relations, and practical guest service recovery—covering nearly every situation that arises in the daily business of hotel reception.
Beyond theory, my ebooks and training videos connect the academic side of hospitality management studies with the real-life practice of hotel front desk duties and responsibilities.
– For students and readers: they bridge classroom study with career preparation, showing how hotel and management course theory link directly to front desk skills.
– For professionals and community visitors: they support career growth through interview tips for receptionist, with step-by-step interview questions for receptionist with answers. There’s also guidance on writing a strong receptionist description for resume.
As someone who has taught hotel and management courses for nearly 30 years, I rarely see materials that balance the academic foundation with the day-to-day hotel front desk job requirements so effectively. This training not only teaches but also simulates real hotel reception challenges—making it as close to on-the-job learning as possible, while still providing structured guidance.
I hope the owners of reddigital.cl, and the readers/visitors of reddigital.cl, will support my ebooks and training videos so more people can access the information and gain the essential skills needed to become a professional hotel receptionist in any hotel or resort worldwide.
Either way, thank you, reddigital.cl, for maintaining such a respectful space online.
Hey there.
reddigital.cl, Thanks for keeping a thoughtful corner of the internet alive.
I recently published my ebooks and training videos on
https://www.hotelreceptionisttraining.com/
They feel like a hidden gem for anyone interested in hospitality management studies. These ebooks and videos have already been welcomed and found very useful by students in Russia, the USA, France, the UK, Australia, Spain, and Vietnam—helping learners and professionals strengthen their real hotel reception skills. I believe visitors and readers here might also find them practical and inspiring.
Unlike many resources that stay only on theory, this ebook and training video set is closely connected to today’s hotel business. It comes with full step-by-step training videos that guide learners through real front desk guest service situations—showing exactly how to welcome, assist, and serve hotel guests in a professional way. That’s what makes these materials special: they combine academic knowledge with real practice.
With respect to the owners of reddigital.cl who keep this platform alive, I kindly ask to share this small contribution. For readers and visitors, these skills and interview tips can truly help anyone interested in becoming a hotel receptionist prepare with confidence and secure a good job at hotels and resorts worldwide. If found suitable, I’d be grateful for it to remain here so it can reach those who need it.
Why These Ebooks and Training Videos Are Special
They uniquely combine academic pathways such as a bachelor of hospitality management or a advanced hotel management course with very practical guidance on the hotel front desk job duties. They also cover the hotel front desk receptionist job description, and detailed hotel front desk tasks.
The materials go further by explaining the hotel reservation process, hotel check-in, check-out flow, guest relations, and dealing with guest complaints—covering nearly every situation that arises in the daily business of a front office operation.
Beyond theory, my ebooks and training videos connect the academic side of hospitality management studies with the real-life practice of hotel front desk duties.
– For students and readers: they bridge classroom study with career preparation, showing how hotel and management course theory link directly to front desk skills.
– For professionals and community visitors: they support career growth through interview tips for receptionist, with step-by-step interview questions for receptionist with answers. There’s also guidance on writing a strong receptionist job description for resume.
As someone who has taught hospitality management programs for nearly 30 years, I rarely see materials that balance the academic foundation with the day-to-day job description of front desk receptionist in hotel so effectively. This training not only teaches but also simulates real hotel reception challenges—making it as close to on-the-job learning as possible, while still providing structured guidance.
I hope the owners of reddigital.cl, and the readers/visitors of reddigital.cl, will support my ebooks and training videos so more people can access the information and gain the essential skills needed to become a professional hotel receptionist in any hotel or resort worldwide.
Wishing you continued success with your site—truly.
Hi!
reddigital.cl, I appreciate the care you put into this space—it really shows.
I recently published my ebooks and training videos on
https://www.hotelreceptionisttraining.com/
They feel like a standout resource for anyone interested in hospitality management studies. These ebooks and videos have already been welcomed and found very useful by students in Russia, the USA, France, the UK, Australia, Spain, and Vietnam—helping learners and professionals strengthen their real hotel reception skills. I believe visitors and readers here might also find them practical and inspiring.
Unlike many resources that stay only on theory, this ebook and training video set is closely connected to today’s hotel business. It comes with full step-by-step training videos that guide learners through real front desk guest service situations—showing exactly how to welcome, assist, and serve hotel guests in a professional way. That’s what makes these materials special: they combine academic knowledge with real practice.
With respect to the owners of reddigital.cl who keep this platform alive, I kindly ask to share this small contribution. For readers and visitors, these skills and interview tips can truly help anyone interested in becoming a hotel receptionist prepare with confidence and secure a good job at hotels and resorts worldwide. If found suitable, I’d be grateful for it to remain here so it can reach those who need it.
Why These Ebooks and Training Videos Are Special
They uniquely combine academic pathways such as a bachelor’s degree in hospitality management or a master’s degree in hospitality management with very practical guidance on the hotel front desk job duties. They also cover the hotel front desk job description, and detailed hotel front desk duties and responsibilities.
The materials go further by explaining the reservation systems in hotels, check-in and check-out procedures, guest relations, and practical guest service recovery—covering nearly every situation that arises in the daily business of hotel reception.
Beyond theory, my ebooks and training videos connect the academic side of hospitality management studies with the real-life practice of hotel front desk duties.
– For students and readers: they bridge classroom study with career preparation, showing how hotel and management course theory link directly to front desk skills.
– For professionals and community visitors: they support career growth through interview tips for receptionist, with step-by-step interview questions for receptionist with answers. There’s also guidance on writing a strong receptionist description for resume.
As someone who has taught resort management for nearly 30 years, I rarely see materials that balance the academic foundation with the day-to-day hotel front desk job responsibilities so effectively. This training not only teaches but also simulates real hotel reception challenges—making it as close to on-the-job learning as possible, while still providing structured guidance.
I hope the owners of reddigital.cl, and the readers/visitors of reddigital.cl, will support my ebooks and training videos so more people can access the information and gain the essential skills needed to become a professional hotel receptionist in any hotel or resort worldwide.
Either way, thank you, reddigital.cl, for maintaining such a respectful space online.
Really enjoyed this article. Your perspective is very refreshing.
Just thought I’d share something that could benefit hotel owners and travel brands. We recently launched a super easy-to-use smart tourism chatbot designed especially for hospitality businesses looking to boost bookings, guest satisfaction, and 24/7 support—on autopilot.
It’s a lightweight chatbot widget that installs in minutes—zero coding required. This tourism chatbot runs all day and night to capture booking leads, even connecting with CRM tools.
See full details and live demo here:
https://chatbotforleads.blogspot.com/2025/04/boost-bookings-and-guest-satisfaction.html
But here’s the best part: besides hotel and tourism, we also offer a full range of chatbot solutions that work beautifully on any website, in any industry, to generate leads in a simple, smart, and wonderful way—only $69 lifetime. No subscriptions. No tech headaches.
Use it as a lead gen chatbot—and test it out instantly on our blog.
With nearly 30 years of experience in business development, we built this tool to be one of the most affordable options available for small businesses.
So if you’re ready to automate your site, or just want a chatbot that works—we’d love for you to check it out.
Would love your feedback if you try it!
Good day,
A quick thank-you to reddigital.cl for sharing such insightful and well-written content. It’s always nice to come across a website where the information is clear, useful, and genuinely designed to assist readers.
I also wanted to add something that might be genuinely helpful for anyone dealing with sleep conditions or problems sleep, or anyone who simply wants to sleep well and improve sleep quality. Recently, someone shared their experience with a natural supplement called ChronoBoost Pro (https://shorturl.at/hKquX) , and the feedback was surprisingly positive.
Unlike typical sleep aids, this formula is designed to support the body’s natural sleep–wake cycle, supporting your ability to fall inside sleep, sleep through the night more peacefully, and wake up feeling refreshed. It’s intended to help sleep without harsh medications, making it a gentle way to support sleep support.
Many of its ingredients are familiar sleep herbs and vitamins to help sleep, like magnesium to help you sleep, ashwagandha, L-theanine, and other calming herbal extracts. These are known for their role in sleep support and can naturally improve sleep and overall sleep quality. You can also improve your sleep with these ingredients.
Sleep is important not only for physical health but also for the brain. Research on sleep and the brain shows that sleep helps the sleep brain function optimally, boosting overall brain health. Vitamins and sleep, as well as certain food helps sleep, can further enhance these benefits. Taking sleep vitamins or herbs to help you sleep may be a simple way to naturally improve your sleep routine and support your daily energy.
Of course, results can vary, and this is not a miracle cure for everyone. But if you’re looking for a natural help to sleep or want to understand why sleep is needed and why sleep why is it important, this could be a worthwhile option. If you’re curious, the person who recommended it shared the link they used: https://shorturl.at/hKquX.
Hopefully, this helps anyone looking to improve your sleep, support your sleep brain, and enjoy all the benefits sleep provides. If anyone here has tried it before, it would be great to hear your experience as well! Many thanks, and hope it helps you sleep well!
Greetings,
I’d like to express my appreciation to reddigital.cl for sharing such useful and well-written content. It’s always refreshing to come across a website where the information is clear, useful, and genuinely created to support readers.
I also wanted to share something that may help for anyone dealing with sleep conditions or problems sleep, or anyone who simply wants to sleep well and improve sleep quality. Recently, someone shared their experience with a natural supplement called ChronoBoost Pro (https://shorturl.at/hKquX) , and the feedback was surprisingly positive.
Unlike typical sleep aids, this formula is designed to support the body’s natural sleep–wake cycle, making it easier to fall inside sleep, drift into sleep naturally, and feel rejuvenated in the morning. It’s intended to help sleep without harsh medications, making it a gentle approach to naturally improve your sleep.
Many of its ingredients are familiar sleep herbs and vitamins to help sleep, like magnesium to help you sleep, ashwagandha, L-theanine, and other calming herbal extracts. These are known for their role in sleep support and can naturally improve sleep and overall sleep quality. You can also improve your sleep with these ingredients.
Sleep is important not only for physical health but also for the brain. Research on sleep and the brain shows that sleep helps the sleep brain function optimally, enhancing mental performance and alertness. Vitamins and sleep, as well as certain food helps sleep, can further enhance these benefits. Taking sleep vitamins or herbs to help you sleep may be a simple way to naturally improve your sleep routine and support your daily energy.
Of course, results can vary, and this is not a miracle cure for everyone. But if you’re looking for a natural help to sleep or want to understand why sleep is needed and why sleep why is it important, this could be a worthwhile option. If you’re curious, the person who recommended it shared the link they used: https://shorturl.at/hKquX.
Hopefully, this helps anyone looking to improve your sleep, support your sleep brain, and enjoy all the benefits sleep provides. If anyone here has tried it before, it would be great to hear your experience as well! Grateful for your attention, and wishing you restful nights!
Hi there reddigital.cl,
You’re providing very useful content for your readers.
We help website owners and bloggers to get qualified traffic and convert visitors into potential clients. Using the same method that reached you — posting targeted blog comments and contact form messages in your niche and location — our chatbot engages these visitors automatically to capture leads efficiently.
As a special offer, if you purchase our chatbot service (normally $69, now $49), simply tell us your website, and we will take care of the comment and contact form service for you. We’ll create 1000 targeted comments or submissions to bring visitors interested in your niche and location — worldwide.
We provide chatbots for many niches: all-purpose bots, real estate, dental, education, hotels & tourism, bars, cafés, automotive, and more.
See the full system here: https://chatbotforleads.blogspot.com/ — it shows clearly how the traffic and lead generation works in action.
Many thanks for taking a moment to read this, and Wishing you and your website continued success.
Hello reddigital.cl,
You’re providing insightful content for your readers.
We support website owners and bloggers to get real, targeted traffic and convert visitors into potential clients. Using the same method that reached you — posting targeted blog comments and contact form messages in your niche and location — our chatbot engages these visitors automatically to capture leads efficiently.
As a special offer, if you purchase our chatbot service (normally $69, now $49), simply tell us your website, and we will handle the comment and contact form service for you. We’ll create 1,000 niche-specific entries to bring visitors interested in your niche and location — worldwide.
We provide chatbots for many niches: all-purpose bots, real estate, dental, education, hotels & tourism, bars, cafés, automotive, and more.
See the full system here: https://chatbotforleads.blogspot.com/ — it shows precisely how the traffic and lead generation works in action.
Many thanks for taking a moment to read this, and Wishing you and your website continued success.
Hi reddigital.cl,
You’re providing high-quality content for your readers.
We help website owners and bloggers to get qualified traffic and convert visitors into potential clients. Using the same method that reached you — posting targeted blog comments and contact form messages in your niche and location — our chatbot engages these visitors automatically to capture leads efficiently.
As a special offer, if you purchase our chatbot service (normally $69, now $49), simply tell us your website, and we will handle the comment and contact form service for you. We’ll create 1,000 targeted comments or submissions to bring visitors interested in your niche and location — worldwide.
We provide chatbots for many niches: general chatbots, real estate, dental, education, hotels & tourism, bars, cafés, automotive, and more.
See the full system here: https://chatbotforleads.blogspot.com/ — it shows precisely how the traffic and lead generation works in action.
Appreciate your attention, and Wishing you more engagement and growth with your content.
Hey all,
I’d like to express my appreciation to reddigital.cl for sharing such informative and well-written content. It’s always encouraging to come across a website where the information is clear, useful, and genuinely focused on helping readers.
I also wanted to offer something that could help for anyone dealing with sleep conditions or problems sleep, or anyone who simply wants to sleep well and improve sleep quality. Recently, someone shared their experience with a natural supplement called ChronoBoost Pro (https://shorturl.at/hKquX) , and the feedback was surprisingly positive.
Unlike typical sleep aids, this formula is designed to support the body’s natural sleep–wake cycle, supporting your ability to fall inside sleep, enjoy uninterrupted sleep, and feel rejuvenated in the morning. It’s intended to help sleep without harsh medications, making it a gentle way to support sleep support.
Many of its ingredients are familiar sleep herbs and vitamins to help sleep, like magnesium to help you sleep, ashwagandha, L-theanine, and other calming herbal extracts. These are known for their role in sleep support and can naturally improve sleep and overall sleep quality. You can also improve your sleep with these ingredients.
Sleep is important not only for physical health but also for the brain. Research on sleep and the brain shows that sleep helps the sleep brain function optimally, boosting overall brain health. Vitamins and sleep, as well as certain food helps sleep, can further enhance these benefits. Taking sleep vitamins or herbs to help you sleep may be a simple way to naturally improve your sleep routine and support your daily energy.
Of course, results can vary, and this is not a miracle cure for everyone. But if you’re looking for a natural help to sleep or want to understand why sleep is needed and why sleep why is it important, this could be a worthwhile option. If you’re curious, the person who recommended it shared the link they used: https://shorturl.at/hKquX.
Hopefully, this helps anyone looking to improve your sleep, support your sleep brain, and enjoy all the benefits sleep provides. If anyone here has tried it before, it would be great to hear your experience as well! Thank you for reading, and have a calm and restful night!
Hi friends,
I wanted to take a moment to thank to reddigital.cl for sharing such informative and well-written content. It’s always great to come across a website where the information is clear, useful, and genuinely meant to help readers.
I also wanted to add something that might be genuinely helpful for anyone dealing with sleep conditions or problems sleep, or anyone who simply wants to sleep well and improve sleep quality. Recently, someone shared their experience with a natural supplement called ChronoBoost Pro (https://shorturl.at/hKquX) , and the feedback was surprisingly positive.
Unlike typical sleep aids, this formula is designed to support the body’s natural sleep–wake cycle, supporting your ability to fall inside sleep, wake up feeling refreshed, and wake up feeling refreshed. It’s intended to help sleep without harsh medications, making it a gentle approach to naturally improve your sleep.
Many of its ingredients are familiar sleep herbs and vitamins to help sleep, like magnesium to help you sleep, ashwagandha, L-theanine, and other calming herbal extracts. These are known for their role in sleep support and can naturally improve sleep and overall sleep quality. You can also improve your sleep with these ingredients.
Sleep is important not only for physical health but also for the brain. Research on sleep and the brain shows that sleep helps the sleep brain function optimally, boosting overall brain health. Vitamins and sleep, as well as certain food helps sleep, can further enhance these benefits. Taking sleep vitamins or herbs to help you sleep may be a simple way to naturally improve your sleep routine and support your daily energy.
Of course, results can vary, and this is not a miracle cure for everyone. But if you’re looking for a natural help to sleep or want to understand why sleep is needed and why sleep why is it important, this could be a worthwhile option. If you’re curious, the person who recommended it shared the link they used: https://shorturl.at/hKquX.
Hopefully, this helps anyone looking to improve your sleep, support your sleep brain, and enjoy all the benefits sleep provides. If anyone here has tried it before, it would be great to hear your experience as well! Grateful for your attention, and have a calm and restful night!
So many people underestimate the power of small steps—this post reminded me why consistency matters.
If you’re looking for a proven way to take control of your habits without burning out, this book is a game-changer. It teaches you how to make tiny changes that lead to remarkable results in productivity, mindset, and motivation.
If you’ve ever tried to change your habits and failed, this book shows you a better, more realistic way. It’s not about perfection. It’s about progress.
You can read more and get the book here:
https://www.hotelreceptionisttraining.com/2025/05/mini-habits-major-results-simple-proven.html
If you’re ready to stop struggling with willpower and start seeing results through smart, simple steps—this might be the proven way you’ve been waiting for.
This book changed the way I think about habit formation—and honestly, it helped me change my life.
Reading this post really made me pause and think about how many of my daily choices are shaped by old habits and unconscious routines.
If you’re looking for a proven way to take control of your habits without burning out, this book is a game-changer. It teaches you how to make tiny changes that lead to remarkable results in productivity, mindset, and motivation.
What makes this book different is that it focuses on minimum viable habits—just tiny actions that remove resistance and help you stick with real goals over time.
You can read more and get the book here:
https://www.hotelreceptionisttraining.com/2025/05/mini-habits-major-results-simple-proven.html
If you’re ready to stop struggling with willpower and start seeing results through smart, simple steps—this might be the proven way you’ve been waiting for.
This book changed the way I think about habit formation—and honestly, it helped me change my life.
Hello reddigital.cl,
You’re providing very useful content for your readers.
By the way, I know a fantastic platform that can make your website more attractive. It’s an AI-powered platform that turns concepts into fun, shareable doodle videos in just a few clicks. Everything works online in the cloud.
Whether you’re a marketer, this tool helps you create engaging videos that captivate your audience. Imagine your content being more memorable and shareable.
Plus, these videos are a fun way to engage your followers and boost visibility, and they’re also excellent for presentations.
Check it out here: https://tinyurl.com/instadvideo
I thought this might be helpful for your audience. It’s simple, effective, and highly engaging.
Thank you for your time, and wishing you continued success with your content.
Hello reddigital.cl,
You’re providing amazing content for your readers.
By the way, I know a fantastic platform that can make your website more attractive. It’s an AI-powered platform that transforms your ideas into professional whiteboard doodle videos in just a few clicks. No technical or design skills are needed.
Whether you’re a small business owner, this tool helps you create engaging videos that captivate your audience. Imagine turning any concept, product, or story into a fun, shareable video.
Plus, these videos are perfect for social media pages, and they’re also amazing for pitching ideas.
Check it out here: https://tinyurl.com/instadvideo
I thought this might be helpful for your audience. It’s simple, effective, and highly engaging.
Appreciate your attention, and I hope this helps you and your audience create more engaging content.